
新闻中心
News Center 热门搜索:
热门搜索:  更新时间:2024-06-26
更新时间:2024-06-26 点击次数:
点击次数: 菟丝子为旋花科菟丝子属植物南方菟丝子 Cuscuta australis R. Br. 或菟丝子 C. chinensis Lam. 的干燥成熟种子,归肝、肾、脾经 [1] 。菟丝子临床应用广泛,对生殖系统 [2-3] 、免疫系统 [4-5] 、骨骼系统 [6-7] 疾病均有显著疗效,并有保肝 [8] 、降糖 [9] 、抗衰 [10] 作用。因其为种子类药材,种皮致密坚实,不易打碎,因此古今大多以其炮制品入药。菟丝子常用炮制品有炒菟丝子、盐菟丝子、酒菟丝子和菟丝子饼。在古代,应用最多的是其酒制品 [11] 。传统炮制理论认为,酒制升提,可治疗肝肾不足导致的下陷之证,还可增强菟丝子的温补作用 [12] ;现代研究也发现,酒可使药材中活性成分溶出度增加,进而提高其药效 [13] 。因此,关于菟丝子酒制品的研究具有一定的临床应用意义。
菟丝子主要含有黄酮类、苯丙素类化合物[14] ,现有研究证明,菟丝子酒制品中总黄酮含量和挥发性成分含量增加[15-16] 。为明晰菟丝子酒炙前后的化学成分变化情况,本研究利用UPLC 技术,采用分段波长,建立了菟丝子炮制前后指纹图谱,并结合相似度评价、层次聚类分析(hierarchical clustering analysis ,HCA )、主成分分析(principal component analysis ,PCA ),正交偏最小二乘- 判别分析(orthogonal partial least squares-discriminant analysis ,OPLS-DA )对其进行综合评价,同时对菟丝子中主要的5 种黄酮类成分(金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚)、4 种酚酸类成分(新绿原酸、绿原酸、隐绿原酸、异绿原酸C )进行含量测定,探求菟丝子炮制前后的差异性成分,以期为酒菟丝子质量标准的制定及炮制前后药理作用的研究提供参考。
1290 Infinity II 型超高效液相色谱仪,安捷伦科技有限公司;ME204E 型万分之一分析天平,梅特勒- 托利多仪器上海有限公司;XS205DU 型十万分之一分析天平,梅特勒- 托利多国际有限公司;JM- 30D-40 型液晶单频超声波清洗仪,深圳市洁盟清洗设备有限公司;LC-EA6S 型电陶炉,广东顺德忠臣电器有限公司;WGH201 型纯水机,Yamato 科学株式会社。
1.2.1试剂 甲醇、乙腈,帝蒽科国际贸易有限公司,色谱纯;磷酸,天津市科密欧化学试剂有限公司,色谱纯;超纯水,实验室自制。
1.2.2试药 对照品金丝桃苷(质量分数94.3% ,批号11 )、绿原酸(质量分数96.6% ,批号11 )、槲皮素(质量分数99.1% ,批号10 )、山柰酚(质量分数93.2% ,批号11 ),以上对照品均购自中国食品药品检定研究院;对照品隐绿原酸(质量分数98% ,批号M06GB147634 )、新绿原酸(质量分数98% ,批号D23GB172337 )、紫云英苷(质量分数98% ,批号10319 )、异绿原酸C (质量分数98% ,批号ST06600120 )、异槲皮苷(质量分数94.6% ,批号ST11441020MG ),以上对照品均购自上海源叶生物科技有限公司。
1.2.3样品 收集来自宁夏、内蒙古2 个产地的生菟丝子药材(表1 ),经山东省中医药研究院林慧彬研究员鉴定,均为旋花科植物南方菟丝子C. australis R. Br. 的干燥成熟种子。
酒炙品:称取约200 g 生菟丝子药材,用10% 黄酒闷润6 h 后,置于热锅内,300 ℃下翻炒10 min 后,倒入托盘内,摊开,晾凉,即得。
取样品粉末(过四号筛)约1 g ,置50 mL 量瓶中,加80% 甲醇40 mL ,超声处理(功率500 W 、频率40 kHz )1 h ,放冷,加80% 甲醇至刻度,摇匀,滤过,滤液过0.22 μm 微孔滤膜,即得供试品溶液。
2.4.1精密度试验 精密称取JS4 (酒菟丝子4 号样品)粉末1 g ,按“2.2 ”项下方法制备成供试品溶液,重复进样6 次,选择峰形对称且响应值较大的13 号金丝桃苷峰为参照峰,测得各共有峰的相对保留时间RSD 均<2% ,相对峰面积RSD 均<3% ,表明仪器精密度良好。
2.4.2重复性试验 精密称取JS4 粉末1 g ,平行6 份,按“2.2 ”项下方法制备成供试品溶液,进样测定,以13 号金丝桃苷为参照峰,计算得到共有峰的相对保留时间RSD 均<2% ,相对峰面积RSD 均<3% ,表明此方法重复性良好。
2.4.3稳定性试验 取JS4 供试品溶液,在0 、2 、4 、8 、16 、24 h 分别进样测定,以13 号金丝桃苷为参照峰,计算各共有峰的相对保留时间RSD 均<2% ,相对峰面积RSD 均<3% ,表明供试品溶液在24 h 内稳定性良好。
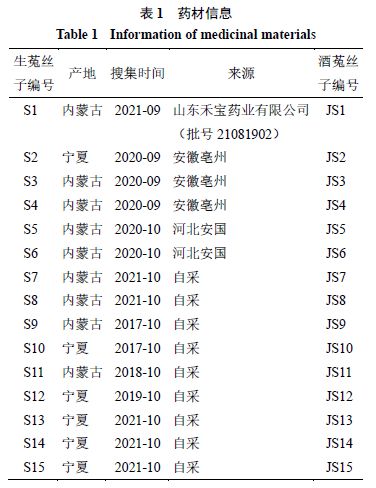
2.4. 4 UPLC 指纹图谱的建立及色谱峰的指认 取“2.3 ”项下混合对照品溶液,按“2.1 ”项下色谱条件进样测定,得到混合对照品色谱图(图1 )。
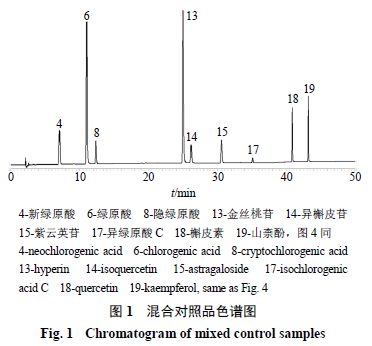
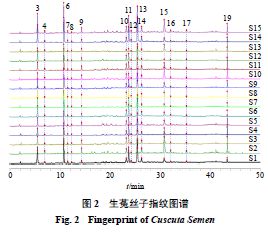
按“ 2.2 ”项下方法分别制备 15 批生菟丝子( S1 ~ S15 )和 15 批酒菟丝子( JS1 ~ JS15 )供试品溶液,按“ 2.1 ”项下色谱条件进样测定,得到 UPLC 图。将 UPLC 图导入《中药色谱指纹图谱相似度评价系统( 2012 版)》,分别以 S1 和 JS1 作为参照图谱,采用中位数法和多点校正,设置时间窗宽度为 0.1 min ,对色谱图进行匹配,分别生成 15 批生菟丝子( S1 ~ S15 )指纹图谱叠加图与 15 批酒菟丝子( JS1 ~ JS15 )指纹图谱叠加图及各自对照特征图谱(图 2 ~ 4 ),共得到 19 个共有峰,其中生菟丝子 15 个共有峰(峰 3 、 4 、 6 ~ 17 、 19 ), 16 个共有峰酒菟丝子(峰 1 ~ 9 、 11 ~ 19 )。经对照品比对,共指认出 4 、 6 、 8 、 13 ~ 15 、 17 ~ 19 号共有峰,分别为新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异槲皮苷、紫云英苷、异绿原酸 C 、槲皮素和山柰酚。
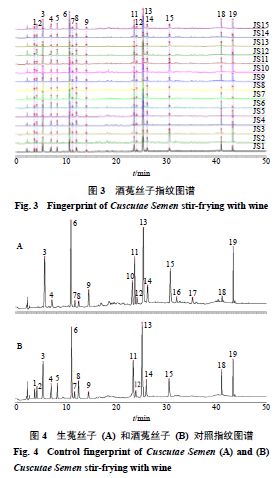
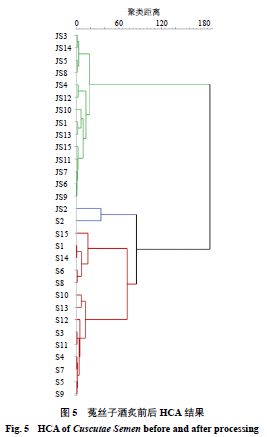
将30 批样品的19 个共有峰峰面积导入SIMCA 14.1 软件中进行HCA ,结果(图5 )显示,菟丝子的生品与酒炙品分别聚为一类,表明菟丝子酒炙前后化学成分发生变化。
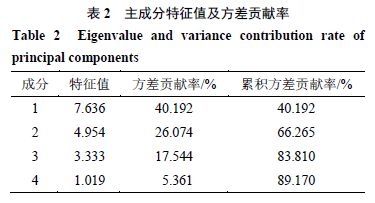
2.4.6 生菟丝子和酒菟丝子 UPLC 指纹图谱的 PCA 将 15 批生菟丝子样品和 15 批酒菟丝子样品 19 个 共有峰峰面积导入 SPSS 21 软件,经过KMO 和Bartlett 检验,KMO =0.668 >0.5 ,P <0.05 ,表明符合因子分析条件,可以进行PCA 。将共有峰标准化处理后进行PCA ,计算主成分特征值及方差贡献率,结果见表2 。以特征值>1 为标准,进行主成分提取,提取出4 个主成分,累积贡献率达到89.170% ,可代表19 个共有峰的主要信息。
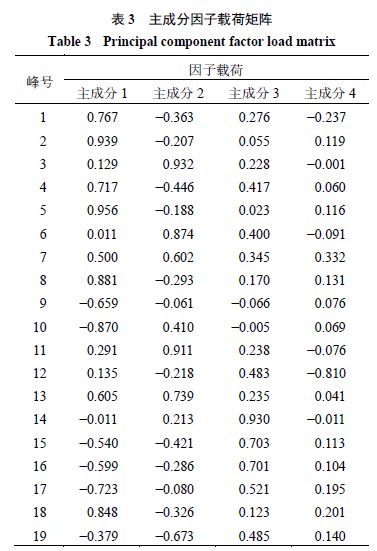
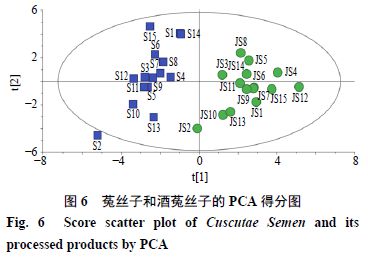
由主成分因子载荷矩阵(表3 )可知,2 、5 、8 、10 、18 号峰对主成分1 (PC1 )影响大,3 、6 、11 号峰对主成分2 (PC2 )影响较大,14 号峰对主成分3 (PC3 )影响大,12 号峰对主成分4 (PC4 )影响大。利用SIMCA 14.1 软件得到PCA 得分图(图6 ),可明显区分酒菟丝子及生菟丝子。其中S2 样品游离于中心椭圆之外,与其他样品不聚集,说明S2 与其他样品存在质量差异,这与相似度结果和聚类分析结果一致。
2.4.7 生菟丝子和酒菟丝子UPLC 指纹图谱的OPLS-DA 在PCA 基础上进一步利用OPLS-DA 对15 批酒菟丝子和15 批生菟丝子样品进行分析,结果如图7 所示。所建立的模型中累积解释能力参数 R 2 X cum 为0.868 ,R2Y cum 为0.977 ,预测能力参数Q2cum 为0.959 >0.5 ,证明此模型为有效模型。
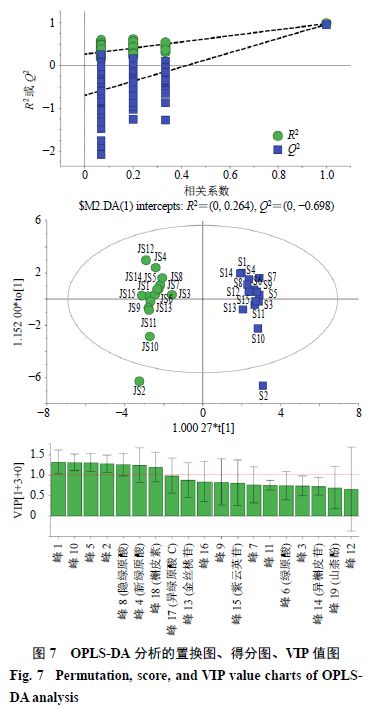
通过置换检验(置换次数为200 次),R2 和Q2 截距值分别为0.259 (<0.4 )和−0.7 (<0.05 ),所有R2 和Q2 的左边的值均低于最右边,证明没有过拟合现象。通过OPLS-DA 分析的得分图可知,生菟丝子与酒菟丝子可被明显区分。
以变量重要性投影值(projection value of variable importance ,VIP )>1 为标准筛选差异性成分,共筛选出8 个差异标志物,是造成酒菟丝子和生菟丝子成分差异的主要成分。影响显著性排序为峰1 >峰10 >峰5 >峰2 >峰8 (隐绿原酸)>峰4 (新绿原酸)>峰18 (槲皮素)>峰17 (异绿原酸C )。比较发现,峰1 、2 为酒炙后新产生的成分,生品中没有;峰10 生品中含有,酒炙后含量降低。
2.5.4精密度、重复性、稳定性考察 具体操作同 “2.4.1 、2.4.2 、2.4.3 ”项。 记录各待测峰的峰面积,并计算各峰 RSD 。测得各峰精密度 RSD <1.90 % ,重复性 RSD < 2.74% ,稳定性 RSD < 1.93% ,表明仪器精密度、方法重复性、样品稳定性均较好。
2.5.5加样回收率考察 精密称定6 份已测定9 个指标成分含量的JS4 样品各0.5 g ,加入与样品含量相近的各对照品适量,按“2.2 ”项下方法平行制备6 份供试品溶液,并按“2.1 ”项下色谱条件进样测定并记录各色谱峰峰面积,计算得到新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异槲皮苷、紫云英苷、异绿原酸C 、槲皮素、山柰酚的平均加样回收率分别为98.26% 、99.50% 、100.67% 、99.69% 、100.26% 、100.34% 、101.09% 、99.14% 、100.94% ,RSD 分别为1.46% 、1.48% 、1.95% 、0.79% 、0.33% 、1.72% 、1.61% 、1.68% 、1.33% 。
2. 5.6 样品测定 按照“2.5.2 ”项下方法制备15 批生菟丝子(S1 ~S15 )及15 批酒菟丝子(JS1 ~JS15 )样品的供试品溶液,按“2.5.1 ”项下色谱条件分别进行含量测定,计算9 个成分的实际含量,含量测定结果见表4 。
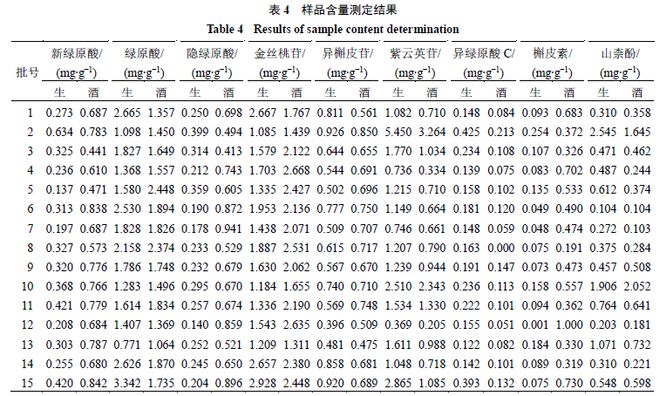
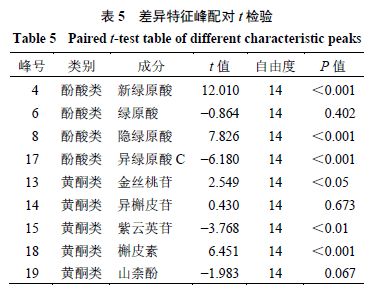
2.5.7 统计学分析 将9 个成分炮制前后的含量进行配对t 检验,结果(表5 )显示酚酸类成分新绿原酸、隐绿原酸、异绿原酸C 炮制前后具有极显著差异(P <0.001 ),绿原酸无明显差异;黄酮类成分槲皮素具有极显著差异(P <0.001 ),紫云英苷、金丝 桃苷具有显著差异(P <0.05 、0.01 ),异槲皮苷无明 显差异。由 t 值可看出,菟丝子经酒炙后黄酮类成分金丝桃苷、异槲皮苷、槲皮素含量增加,紫云英苷和山柰酚含量降低;酚酸类成分中,新绿原酸、隐绿原酸含量增加,绿原酸和异绿原酸C 含量降低。
通过DAD 扫描发现绿原酸、隐绿原酸、新绿原酸、异绿原酸C 在326 nm 下有最大吸收,金丝桃苷、紫云英苷、异槲皮苷在256 nm 下有较大吸收、槲皮素和山柰酚在360 nm 波长下有最大吸收,因此泛亚电竞app下载,采用分段波长进行指纹图谱研究并同时进行含量测定,以期对炮制前后化学成分的变化进行针对性的研究。
基于所建立的指纹图谱,通过化学模式识别,能够明显区分酒菟丝子及生菟丝子。相似度结果表明,除第 2 批外,各批次样品炮制前后相似度均较高;聚类分析能够明显区分酒菟丝子和生菟丝子,但将第2 批样本单独聚类,说明第2 批样本与其他样本存在质量差异,这可能与第2 批样品杂质率较高有关;通过PCA 提取出4 个主成分,并将生菟丝子和酒菟丝子明显区分;OPLS-DA 亦可将生菟丝子与酒菟丝子明显区分,基于VIP 值,筛选出8 个差异性成分,影响显著性排序顺序为峰1 >峰10 >峰2 >峰5 >峰8 (隐绿原酸)>峰4 (新绿原酸)>峰18 (槲皮素)>峰17 (异绿原酸C )。
通过已知成分的含量测定,发现菟丝子酒炙后变化较为明显的是酚酸类成分,其中隐绿原酸、新绿原酸含量显著增加,这是因为生品中含量较高的绿原酸与异绿原酸都含有邻二酚羟基结构,炮制过程中的加热易使其氧化分解,导致含量降低,且绿原酸会分解为新绿原酸和隐绿原酸[17] 。
黄酮类成分中金丝桃苷、异槲皮苷含量增加,可能因加热和辅料黄酒的参与,从而导致溶出度增加有关。而炮制后显著增加的槲皮素,可能是含有槲皮素结构的黄酮苷类成分受热分解后产生[18] ,这也与相关研究结果一致[19] 。而传统理论认为菟丝子酒制后补肾壮阳作用增强,说明酚酸类成分及黄酮类成分为菟丝子补肾壮阳作用的主要活性成分。
综上所述,本研究通过 UPLC 指纹图谱的建立,对菟丝子炮制前后的化学成分进行定性定量分析,发现菟丝子酒炙后化学成分发生明显变化,与生品存在较大差异,这与前期相关研究一致[20-21] 。而在筛选出的指标性差异成分中,峰1 、2 、5 、10 仍需要后续实验对其进行结构解析和对照品比对加以确定。本研究一定程度上阐述了酒菟丝子的炮制机制,为后续炮制前后药效变化研究及酒菟丝子质量标准的制定提供参考。
来 源:张秀如,于 明,崔雅晴,焦春梅,管仁伟,郭瑞齐,张翠翠,林建强,林慧彬.基于UPLC指纹图谱的菟丝子酒炙前后化学模式识别及多成分定量测定 [J]. 中草药, 2023, 54(9):2733-2740.
【福利时刻】毕业季找工作点击链接,多家企业30W+年薪工作招聘任你选(赶紧点击进入注册,上传简历吧~ ) 。